تحولات نوین در فناوری نانوذرات لیپیدی
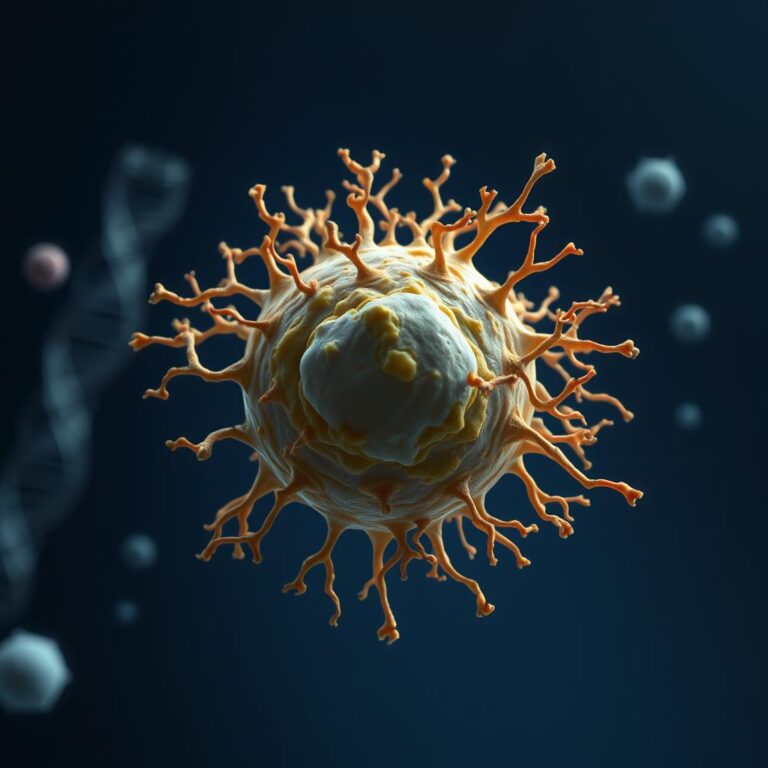
مهندسان دانشگاه پنسیلوانیا با اعمال تغییراتی بر روی نانوذرات لیپیدی (LNPs)، که فناوری انقلابی پشت پرده واکسنهای mRNA کووید-۱۹ به شمار میروند، توانستهاند این ذرات را طوری بهینه کنند که نه تنها از سد خونی-مغزی (BBB) عبور کنند، بلکه به طور خاص سلولهای ویژهای مثل نورونها را هدف قرار دهند. این دستاورد مهم، گامی بزرگ در جهت تولید درمانهای نسل آینده برای بیماریهای عصبی مانند آلزایمر و پارکینسون تلقی میشود.
هدفگیری دقیق با استفاده از پپتیدها
در مقالهای جدید که در نشریه Nano Letters منتشر شده، محققان نشان دادهاند که چگونه میتوان از پپتیدها، که رشتههای کوتاهی از آمینواسیدها هستند، به عنوان مولکولهایی برای هدفگیری دقیق استفاده کرد. این امر به LNPs اجازه میدهد تا mRNA را به طور خاص به سلولهای اندوتلیال که دیواره رگهای خونی مغز را میپوشانند، و همچنین نورونها منتقل کنند. این پیشرفت، گامی کلیدی در انتقال mRNA به انواع سلولهایی خواهد بود که در درمان بیماریهای تحلیلبرنده عصبی نقش اساسی دارند. نکته مهم در هر درمانی این است که مطمئن شویم mRNA به محل درست میرسد.
مطالعات قبلی همین محققان، عبور LNPs از BBB و انتقال mRNA به مغز را ثابت کرده بود، اما تا آن زمان تلاشی برای کنترل نوع سلولهایی که LNPs به آنها میروند، صورت نگرفته بود. مایکل جی. میچل، استاد همکار در رشته مهندسی زیستی و نویسنده ارشد مقاله، میگوید: «مقاله اول ما، طراحی نانوذرات لیپیدی را به عنوان یک اثبات مفهوم (proof-of-concept) مورد بررسی قرار میداد. این شبیه این بود که نشان دهیم میتوانیم بستهای را از پنسیلوانیا به کالیفرنیا بفرستیم، اما نمیدانستیم بسته در کالیفرنیا به کجا خواهد رسید. حالا، با استفاده از پپتیدها، میتوانیم بسته را به مقاصد خاصی که ویژگیهای مشترکی دارند، مثلاً هرخانهای با صندوق پستی قرمز، هدایت کنیم.»
چالشهای پیشرو در دسترسی به مغز
عبور از BBB کار آسانی نیست، زیرا این ساختار به گونهای تکامل یافته است که تقریباً مانع از ورود هر مولکول مضری یا خارجی، از جمله بسیاری از داروها، به مغز شود. مولکولهای mRNA نیز به دلیل اندازه بزرگ خود، قادر به عبور از این سد نیستند، درست مثل بیشتر داروها. همچنین BBB به طور فعال موادی را که خطرناک میداند، دفع میکند. امیلی هان، دانشجوی دکترا در آزمایشگاه میچل و نویسنده اول مقاله، میگوید: «شما میتوانید یک دارو را مستقیماً به مغز یا نخاع تزریق کنید، اما این روشها بسیار تهاجمی هستند.»
از آنجا که BBB به مولکولهای محلول در چربی اجازه عبور میدهد (به همین دلیل است که موادی مانند الکل و THC بر مغز تأثیر میگذارند)، برخی از ترکیبهای LNPs که از همان خانواده مواد چرب موجود در روغنهای معمولی ساخته شدهاند، میتوانند به طور غیرمستقیم به مغز نفوذ کنند.
مقایسه پپتیدها و آنتیبادیها
تاکنون، بیشتر تحقیقات در زمینه هدفگیری اندامهای خاص با استفاده از LNPs بر ترکیب آنها با آنتیبادیها متمرکز بوده است، که پروتئینهای بزرگی هستند و مانند برچسبهای زیستی عمل میکنند. هان میگوید: «وقتی آنتیبادیها را روی LNPs میگذارید، ممکن است ناپایدار شوند و اندازه آنها بزرگتر شود، که عبور از سد را بسیار دشوار میکند.»
پپتیدها: جایگزینی برای آنتیبادیها
برخلاف آنتیبادیها که میتوانند صدها آمینو اسید داشته باشند، پپتیدها فقط از دهها آمینو اسید تشکیل شدهاند. اندازه کوچکتر آنها نه تنها باعث میشود که بتوان تعداد زیادی از آنها را روی نانوذرات لیپیدی (LNPs) قرار داد، بلکه تولید آنها نیز ارزانتر است. همچنین، احتمال تجمع پپتیدها در طول ساخت LNP یا ایجاد واکنشهای ایمنی ناخواسته در مقایسه با آنتیبادیها بسیار کمتر است.
ایده استفاده از پپتیدها، از یک اتفاق غیرمنتظره بین «هان» و خفاشی که وارد اتاقش شد و احتمال قرار گرفتن او در معرض ویروس هاری را ایجاد کرد، جرقه خورد. هان در حین تحقیق در مورد واکسنهای موجود برای این بیماری، متوجه شد که یکی از راههایی که ویروس هاری از طریق آن از سد خونی مغزی (BBB) عبور میکند، استفاده از گلیکوپروتئین ویروس هاری است. هان میگوید: «در همین زمان با یکی از پپتیدهای بسیار امیدوارکننده ما مواجه شدم»، منظور او مولکولی به نام RVG29 است که یک بخش ۲۹ آمینو اسیدی از آن پروتئین است.
آزمایش مفهوم
برای اطمینان از عملکرد پپتیدها، محققان ابتدا باید تأیید میکردند که پپتیدها به LNPها متصل شدهاند. هان توضیح میدهد: «LNPهای ما ترکیبی پیچیده از اسیدهای نوکلئیک، لیپیدها و پپتیدها هستند. ما باید روشهای کمیسازی را بهینهسازی میکردیم تا پپتیدها را از بین تمام آن سیگنالهای دیگر شناسایی کنیم.» پس از اینکه آنها مطمئن شدند که پپتیدها به LNPها متصل شدهاند، باید مشخص میکردند که آیا LNPهای دارای پپتید (pLNPها) واقعاً به اهداف مورد نظر خود در مدلهای حیوانی رسیدهاند یا خیر. هان اضافه میکند: «این کار واقعاً سخت است، زیرا در مغز، انواع مختلفی از سلولها و مقدار زیادی چربی وجود دارد که میتواند بر اندازهگیریها تأثیر بگذارد.» هان بیش از شش ماه برای توسعه یک پروتکل دقیق زمان گذاشت تا بتواند بافت مغز را به دقت جدا کند، درست مثل یک مکانیک که موتور را باز میکند.
مسیر پیشرو
مرحله بعدی این تیم، تعیین این موضوع است که چه درصدی از نورونها باید با pLNPها درمان شوند تا بتوانند علائم بیماری را به طور قابل توجهی کاهش دهند یا به طور بالقوه بیماریهای عصبی را درمان کنند. میچل میپرسد: «با بازگشت به همان مثال، آیا باید این نانوذرات را به تمام خانهها با صندوق پستی قرمز بفرستیم، یا فقط به 10٪ از آنها؟ آیا 10٪ از نورونها کافی خواهد بود؟» پاسخ به این سؤال، جهت توسعه استراتژیهای تحویل دارو با راندمان بالاتر را مشخص میکند و نوید درمانهای مبتنی بر mRNA برای بیماریهای آلزایمر، پارکینسون و سایر بیماریهای مغزی را به واقعیت نزدیکتر میکند.
این مطالعه در دانشکده مهندسی و علوم کاربردی دانشگاه پنسیلوانیا انجام شده و توسط مؤسسه ملی بهداشت ایالات متحده (DP2 TR002776)، بنیاد بوروز ولکام، بنیاد ملی علوم ایالات متحده (CBET-2145491) و انجمن سرطان آمریکا (RSG-22-122-01-ET) مورد حمایت قرار گرفتهاست. سایر نویسندگان همکار شامل سوفیا تانگ، دونگیون کیم، آماندا موری، کلسه سوینگل، الکس همیلتون، کایتلین مرکشیک، مارشال پادیلا و جکلین لی از مهندسی پن، و روهان پالانکی از مهندسی پن و بیمارستان کودکان فیلادلفیا هستند.
“`




بیشتر بخوانید
مدیتیشن یک روز پربرکت برای جذب عشق وامنیت و سلامتی
خود هیپنوتیزم درمان زود انزالی در مردان توسط هیپنوتراپیست رضا خدامهری
تقویت سیستم ایمنی بدن با خود هیپنوتیزم
شمس و طغری
خود هیپنوتیزم ماندن در رژیم لاغری و درمان قطعی چاقی کاملا علمی و ایمن
خود هیپنوتیزم تقویت اعتماد به نفس و عزت نفس