نقش حیاتی گیرندههای پروتئینیِ جفتشده با G در داروها
تقریباً ۳۵ درصد از داروهایی که به تأیید سازمان غذا و داروی آمریکا (FDA) رسیدهاند، با هدف قرار دادن گیرندههای پروتئینیِ جفتشده با G معروف به GPCRs، کار میکنند. این پروتئینها در غشای سلولی قرار دارن و دروازههای ارتباطی سلولها با یکدیگر محسوب میشن. گیرندههای پروتئینی چسبنده با G – که به اختصار aGPCRs نامیده میشن – دومین خانواده بزرگ از این نوع گیرندهها در بدن انسان هستند. همونطور که از اسمشون پیداست، این گیرندهها به سلولها کمک میکنن تا به هم بچسبن و داخل بدن سیگنال بفرستن. در واقع، در بسیاری از فرایندها از جمله رشد بافتها، عملکرد سیستم ایمنی و شکلگیری اندامها نقش دارن. مشکلاتی که در کارکرد این aGPCRها پیش میاد، میتونه منجر به بیماریهای جدی مثل سرطان، اختلالات مغزی و مشکلات مربوط به رشد بشه. با وجود این نقش پررنگ، هنوز دارویی برای هدف قرار دادن aGPCRها تأیید نشده، چون این گیرندهها اندازه بزرگ، ساختار پیچیده و مطالعه دشواری دارن.
تحقیقات جدید از دانشگاه شیکاگو
مطالعات جدیدی که در دانشگاه شیکاگو انجام شده، از ترکیب دو تکنیک تصویربرداری پیشرفته برای بررسی ساختار کامل یک aGPCRِ رایج استفاده کرده. این تحقیقات به بررسی دقیق چگونگی تعامل ناحیهٔ خارجسلولیِ بلند و پیچیده با ناحیهٔ غشایی که روی سطح سلول قرار داره، میپردازه. به نظر میرسه وضعیتها و حرکات مختلف ناحیه خارجسلولی، راهی کلیدی برای روشن کردن گیرنده باشه. دکتر دیمت آراچ، استاد همکار بیوشیمی و زیستشناسی مولکولی در دانشگاه شیکاگو و نویسنده ارشد این پژوهش، میگه: «این کشف، راههای نوینی برای رساندن دارو به aGPCRها باز میکنه، چون حالا نشون دادیم که ناحیهٔ خارجسلولی با ناحیهٔ غشایی در ارتباطه.» نتایج این تحقیق در شماره اخیر مجلهٔ Nature Communications به چاپ رسیده.

نقش تصاویر و آرایشهای جدید
ناحیهٔ خارجسلولیِ aGPCR از غشای سلول به فضای بیرون سلول امتداد پیدا میکنه، جایی که میتونه با مولکولها و گیرندههای سلولهای دیگه ارتباط برقرار کنه. این ناحیه شامل چند دامنه است، از جمله دامنه GAIN (مخفف GPCR Autoproteolysis INducing) که قابلیت این رو داره که خودش به دو قسمت تقسیم بشه. یک باور رایج اینه که برای فعال شدن aGPCR، یک لیگاند از بیرون سلول به یکی از دامنههای خارجسلولی متصل میشه و فشاری وارد میکنه که باعث میشه دامنه GAIN از بخش دیگهٔ خودش، که یک پپتید معروف به آگونیست متصل (TA) هست، جدا بشه. وقتی TA جدا میشه، میتونه حرکت کنه و با ناحیهٔ غشایی ارتباط برقرار کنه تا سیگنالدهی شروع بشه. اما تحقیقات گسترده در زمینه بیوشیمی نشون میده که خیلی از عملکردهای aGPCR به این مکانیسم جداسازی وابسته نیستن. جدا شدن دامنه GAIN هم غیرقابل برگشت هست و گیرنده رو در حالت «روشن» دائمی قرار میده که میتونه برای سلول مشکلساز باشه. گاهی سلول باید بتونه گیرنده رو روشن و خاموش کنه، پس باید راه دیگهای هم برای این کار وجود داشته باشه.
آزمایشگاه آراچ یازده سال تلاش کرده تا ساختار کامل aGPCRها رو روشن کنه و فهمید که چطور سیگنالهای ورودی از بیرون به داخل سلول منتقل میشن. این گیرندهها بهخاطر نواحی خارجسلولیشون که آرایشهای پیچیده و منحصربهفردی دارن، بسیار سخت مطالعه میشن و درک کاملشون هم دشواره.
تحقیقات جدید در مورد Latrophilin3 و نقش آن در مغز
مطالعات جدیدی که توسط دانشجوی دکترا، سیمن کوردون هدایت میشه، به بررسی ساختار کامل Latrophilin3 اختصاص داره که یک گیرندهٔ پروتئینیِ وابسته به گلیکوپروتئین (aGPCR) محسوب میشه. این گیرنده در رشد سیناپسهای مغزی نقش داره و با «اختلال کمتوجهی و بیشفعالی»(ADHD) و انواع مختلفی از سرطانها مرتبط است. کوردون و همکارش آراچ، فرایند تولید و خالصسازی Latrophilin3 رو بهبود بخشیدن و تصاویر اولیه از طریق میکروسکوپ الکترونی رو ثبت کردن، اما با چالشهای زیادی برای گرفتن یک تصویر مناسب از این گیرنده مواجه شدن.
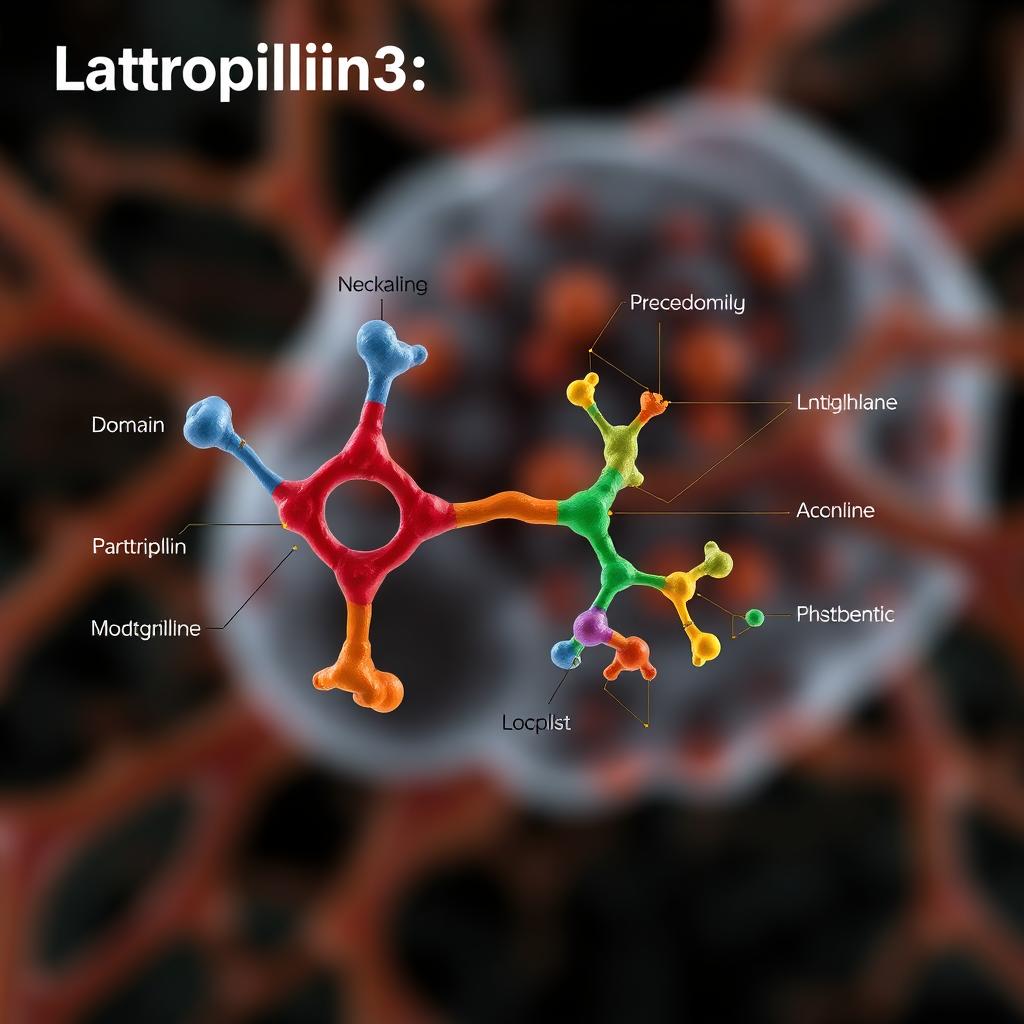
سپس اونها با آنتونی کاسیاکوف، استاد برجسته بیوشیمی و زیستشناسی مولکولی دانشگاه شیکاگو، همکاری کردن تا یک آنتیبادی مهندسی بسازن که بتونه به aGPCR وصل بشه. این آنتیبادی، ناحیهٔ خارجسلولی رو تثبیت کرد و بهش یک شکل مشخص داد که به کوردون اجازه داد تا ساختار کامل گیرنده رو با استفاده از میکروسکوپ الکترونی «کریو» (cryo-EM) ثبت کنه. این تکنیک تصویربرداری، سلولها و مولکولها رو منجمد میکنه تا یک تصویر ثابت به دست بیاد. تصاویری که به دست اومد، اولین ساختار شناختهشده از یک aGPCR کامل رو نشون داد.
تصاویر cryo-EM نشون داد که دامنهٔ GAIN گیرنده، در ارتباط با سطح سلول، موقعیتهای متفاوتی به خودش میگیره. هر موقعیت متفاوت از دامنه GAIN، نقطهٔ تماس متفاوتی بین اون و ناحیهٔ غشایی ایجاد میکنه. محققان کنجکاو شدن که آیا این آرایشهای مختلف میتونن راهی متفاوت برای ارتباط با سلول باشن، بدون اینکه دامنه GAIN کاملاً جدا بشه. بنابراین، اونها با رضا وفابخش، استاد یار زیستشناسی مولکولی در دانشگاه نورثوسترن، و کریستینا چکوا، محقق پسادکتری در نورثوسترن، همکاری کردن تا مجموعهای از آزمایشهای دیگه رو انجام بدن که حرکات نواحی خارجسلولی رو ردیابی کنه.
چکوا و تیمش از تصویربرداری انتقال انرژی تشدید فارستر (FRET) استفاده کردن که میتونه انتقال انرژی بین مولکولهای نزدیک به هم رو اندازهگیری کنه. بعد از اینکه نشانگرهای فلورسنت به نقاط مختلف در نواحی خارجسلولی و غشایی aGPCR متصل شدن، اونا تونستن حرکات رو در پاسخ به نیروهای چسبندگی که به اون فشار میآوردن، دنبال کنن. چیزی که دیدن، شک و تردیدشون رو دربارهٔ عملکرد آرایشهای مختلف تأیید کرد. کوردون میگه: «وضعیتهای کنفورماسیونی مختلف با فعالیت سیگنالدهی متفاوتی از گیرنده مرتبط بودن. این نشون میده که این کنفورماسیونها در سیگنالدهیِ پاییندستی در سلول، نقش مهمی دارن.»

یک مسیر جدید برای فعالسازی گیرندهها
کوردون که در سال ۲۰۲۴ فارغالتحصیل شد، بعداً جایزه بهترین پایاننامه رو از دپارتمان بیوشیمی و زیستشناسی مولکولی دانشگاه شیکاگو به دلیل کارش در این پروژه دریافت کرد. آراچ میگه که حالا که اونها درک بهتری از ساختار aGPCRها و نحوهٔ عملکردشون دارن، میتونن این پتانسیل رو بررسی کنن که چطور میشه اونها رو با داروها هدف قرار داد، درست مثل بقیه گیرندهها. محققان میتونن آنتیبادیهایی مشابه اونهایی که در این مطالعه استفاده شده رو طراحی کنن تا برای تصویربرداری تثبیتشون کنن، اما جوری طراحیشون کنن که فعالیتشون رو کنترل کنن.
از اونجایی که aGPCRها شکلها و ساختارهای متفاوتی دارن، این آنتیبادیها میتونن بسیار دقیق عمل کنن. با شناسایی 33 نوع مختلف aGPCR در بدن انسان، فرصتهای زیادی وجود داره. آراچ اضافه میکنه: «این میتونه آیندهٔ دارو رسانی به GPCRهای چسبنده باشه. مزیتش اینه که نواحی خارجسلولی خیلی با هم فرق دارن، بنابراین میتونید اونها رو با دارویی هدف قرار بدید که به بقیه گیرندهها متصل نشه و عوارض جانبی ناخواسته ایجاد نکنه.»




بیشتر بخوانید
مدیتیشن یک روز پربرکت برای جذب عشق وامنیت و سلامتی
خود هیپنوتیزم درمان زود انزالی در مردان توسط هیپنوتراپیست رضا خدامهری
تقویت سیستم ایمنی بدن با خود هیپنوتیزم
شمس و طغری
خود هیپنوتیزم ماندن در رژیم لاغری و درمان قطعی چاقی کاملا علمی و ایمن
خود هیپنوتیزم تقویت اعتماد به نفس و عزت نفس